分子シャペロンのタンパク質フォールディング機構とその利用
メンバー: 養王田正文、野口恵一、福谷洋介
分野: 生物科学
所属: その他
キーワード: Chaperone、 Chaperonin、 Protein folding、 Single molecule tracking、 Proteostasis
ウェブサイト:
研究概要
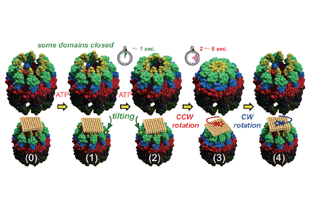
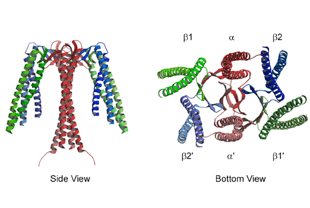
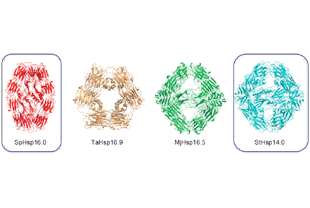
分子シャペロンは細胞内における様々なタンパク質の構造形成や維持を担っている。我々はタンパク質合成の場である細胞質の主要な分子シャペロンであるシャペロニン、プレフォルディン、sHspなどの構造・機能の解明を行っている。最近、東京大学佐々木裕次教授らと共同で、シャペロニンの構造変化を1分子レベルで観察することに成功した。この結果、シャペロンはドミノ倒しのように倒れこみ、反時計回りにねじれる運動することを明らかにした。分子シャペロンはアルツハイマー等のタンパク質凝集病の発症やその抑制に関わると考えられており、これらの研究の成果は、タンパク質凝集病の診断や治療につながる可能性がある。また、細胞を用いたタンパク質生産の高効率化に必要なシャペロンの研究も行っており、その成果はバイオ医薬品の生産に貢献するものである。
主要論文・参考事項
1. Nakagawa, A.et al. (2014) Dissection of the ATP-dependent conformational change cycle of a group II chaperonin. J Mol Biol 426, 447-59.
2. Sekiguchi, H. et al. (2013) ATP dependent rotational motion of group II chaperonin observed by X-ray single molecule tracking. PLoS One 8, e64176.
3. Hanazono, Y. et al.(2013) Nonequivalence observed for the 16-meric structure of a small heat shock protein, SpHsp16.0, from Schizosaccharomyces pombe. Structure 21, 220-8.
4.Ohtaki, A. et al. (2008) Structure and molecular dynamics simulation of archaeal prefoldin: the molecular mechanism for binding and recognition of nonnative substrate proteins. J Mol Biol 376, 1130-41.
5. Kanzaki, T. et al. (2008). Sequential action of ATP-dependent subunit conformational change and interaction between helical protrusions in the closure of the built-in lid of group II chaperonins. J Biol Chem 283, 34773-84.
お問い合わせ先
東京農工大学・先端産学連携研究推進センター
urac[at]ml.tuat.ac.jp([at]を@に変換してください)
Protein folding mechanism and application of molecular chaperone

Research members: Dr. Masafumi Yohda, Dr. Keiichi Noguchi, Dr. Yosuke Fukutani
Research fields: Biological Science
Departments: Department, Center
Keywords: Chaperone, Chaperonin, Protein folding, Single molecule tracking, Proteostasis
Web site:
Summary

Molecular chaperones are involved in folding and quality control of proteins in cell. We are studying structure and mechanism of cytosolic molecular chaperones, such as chaperonin, prefoldin and sHsp. Recently, we performed single molecule observation of the motion of chaperonin in the single molecule level with the group of Professor Sasaki in Tokyo University. Molecular chaperones are thought to be related with onset or control of protein aggregation diseases such as Alzheimer. Studies on molecular chaperone should give some clues for developing methods for diagnosis and treatment for protein aggregation diseases. We are also studying molecular chaperones that are related to high expression of recombinant proteins in cell for the production of biopharmaceutics.
Reference articles and patents
1. Nakagawa, A.et al. (2014) Dissection of the ATP-dependent conformational change cycle of a group II chaperonin. J Mol Biol 426, 447-59.
2. Sekiguchi, H. et al. (2013) ATP dependent rotational motion of group II chaperonin observed by X-ray single molecule tracking. PLoS One 8, e64176.
3. Hanazono, Y. et al.(2013) Nonequivalence observed for the 16-meric structure of a small heat shock protein, SpHsp16.0, from Schizosaccharomyces pombe. Structure 21, 220-8.
4.Ohtaki, A. et al. (2008) Structure and molecular dynamics simulation of archaeal prefoldin: the molecular mechanism for binding and recognition of nonnative substrate proteins. J Mol Biol 376, 1130-41.
5. Kanzaki, T. et al. (2008). Sequential action of ATP-dependent subunit conformational change and interaction between helical protrusions in the closure of the built-in lid of group II chaperonins. J Biol Chem 283, 34773-84.
Contact
University Research Administration Center(URAC),
Tokyo University of Agriculture andTechnology
urac[at]ml.tuat.ac.jp
(Please replace [at] with @.)